2023年4月25日,国家药监局医疗器械技术审评中心、海南省药监局、乐城管理局联合制定并发布了《海南博鳌乐城国际医疗旅游先行区医疗器械临床真实世界数据应用前置沟通工作实施办法(试行)》,以下简称《实施办法》,并于近日开始落地实施。《实施办法》的颁布对于博鳌乐城特许器械开展用于产品注册的真实世界研究起到了极大的推动作用。
《实施办法》的颁布,是在“真研试点”基础上持续的创新与深化,推动了乐城特许药械开展真研辅助产品注册上市的常态化、制度化。其扩大了前置沟通的服务范围,确定了由海南省局进行前置沟通,提高了前置沟通申请的效率,明确了前置沟通申请的材料要求,为企业通过真研辅助产品注册提供了政策便利。
一.前置沟通服务规模扩大
《实施办法》中描述,“本办法适用于符合《海南自由贸易港博鳌乐城国际医疗旅游先行区临床急需进口药品医疗器械管理规定》的临床急需进口医疗器械,在乐城先行区开展用于产品注册的医疗器械真实世界研究,并经海南省局确认纳入前置沟通服务的产品。”即,所有在博鳌乐城开展真研的特许药械都可以进行前置沟通服务的申请,且经海南省局形式审查通过后即可纳入前置沟通服务范围。与过去“真研试点”阶段每年只有10个名额相比较,服务规模大幅增加。
二.明确各方职责,提高沟通效率
国家局器审中心,海南省局与乐城管理局三局联动,职责分明。海南省局将承担起前置沟通服务的职责。海南省局会对材料进行严格的审查,保证材料符合审评要求。在遇到较为复杂的技术问题时,海南省局也会邀请国家局给予技术指导,自下而上助力产品顺利获得国家局器审中心的注册受理。

三. 工作流程优化,缩短前置沟通服务确认时间
企业按要求提交相关资料后,省局给出最终确认的时间不超过14个工作日。确认纳入的产品将按照首次交流会,中期辅导,末次交流会完成前置沟通流程。
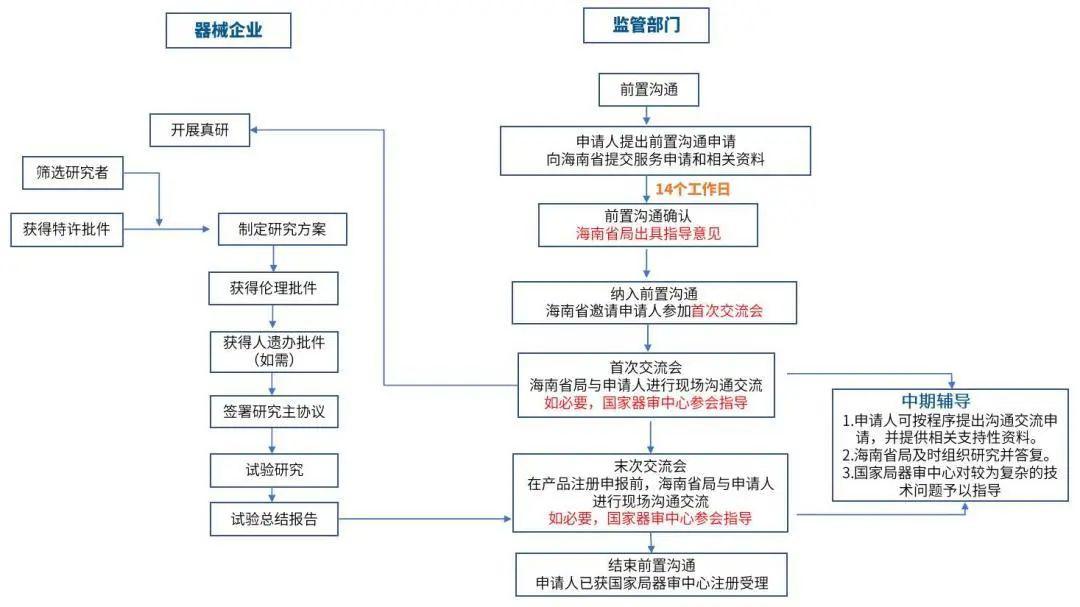
对于提交前置沟通的申请材料,海南省局已于5月19日发布指南。申请企业需按要求通过海南省真实世界数据平台提交相关材料,提交的材料需准确、完整。产品基本资料中,重点关注资料中涉及内容的一致性、合规性及准确性。产品名称、型号规格、厂名地址、适用范围等前后要保持一致;产品命名,上市依据、授权批件等要符合法规要求;在撰写产品综述、原理组成、临床研究结论、人种差异结论,不良反应情况时,均应与实际情况保持一致,避免虚报,瞒报的情况。真实世界研究资料重点从科学性、规范性、可操作性和伦理符合性阐述真研解决的问题。材料的准确、完整是省局审核提效的重要条件。
博鳌乐城特许药械开展真实世界研究辅助产品注册上市经历了几个重要的历史时刻。2019年9月,国家发改委、国家卫建委、国家中医药局、国家药监局四部委联合发布《关于印发<支持建设乐城国际旅游先行区的实施方案>的通知》,鼓励在乐城先行区开展真实世界研究,对先行区范围内临床急需少量进口药品、医疗器械的符合要求的临床使用数据,可以用于进口药品,医疗器械注册申请。此实施方案为乐城特许药械开展真研用于产品注册申请提供了政策保障。2019年10月由国家药监局和海南省药监局主办临床真实世界医疗器械试点产品研讨会,确定了首批10个品种,真正把真实世界数据应用落实到操作阶段。2020年3月,首个特许医疗器械通过境外临床试验数据加真实世界研究试点数据的方式获批上市,让我们看到了通过博鳌乐城特许药械开展真研用于产品注册成为可能。
截止到目前,已有9个特许药械完成注册上市,大大提振了国际药械厂商持续在乐城加大产品投放和开展真实世界研究的信心。
附件:
https://amr.hainan.gov.cn/himpa/ywdt/gzdt/202305/t20230519_3418865.html海南博鳌乐城国际医疗旅游先行区医疗器械临床真实世界数据应用前置沟通资料提交指南(试行)